بازدید امروز : 18
بازدید دیروز : 45
کل بازدید : 125506
کل یادداشتها ها : 148
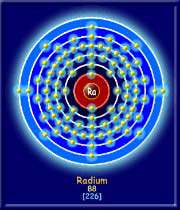
رادیوم ، یکی از عناصر شمیایی جدول تناوبی است که نماد آن Ra و عدد اتمی آن 88 میباشد. ظاهرش تقریبا کاملا سفید است که در مجاورت با هوا سیاه میشود. رادیوم از گروه فلزات قلیایی خاکی بوده و همراه با اورانیوم یافت میشود. این عنصر بهشدت رادیواکتیو بوده و ایزوتوپ پایدار آن 226 با نیم عمر 1602 سال است که به گاز کشنده رادون تبدیل میشود. در سنگهای معدنی اورانیم همیشه رادیوم به مقدار خیلی کم وجود دارد (حدود 1 گرم رادیوم در 3 تن اورانیوم). به این سبب استخراج رادیوم فرایند پرزحمتی است.رادیوم یکی از فلزات کمیاب و بسیار گرانبهاست. و به عنوان چشمه متمرکز تابش پرتوزا ارزش زیادی دارد. تا قبل از این که ماری کوری سال 1895 میلادی تحقیقات خود را درباره کشف عناصر مختلف و شناخت خصوصیات آنها آغاز کند، هیچکس درباره عنصر رادیوم اطلاعی نداشت و در حقیقت این عنصر هنوز کشف نشده بود.
البته هانری بکرل، فیزیکدان فرانسوی در نتیجه تحقیقات خود متوجه شده بود که این عنصر شیمیایی در مقایسه با دیگر عناصر خواص متفاوتی دارد و پرتوهای نامرئی با خصوصیات شگفتانگیز از خود منتشر میکند.
رادیوم در سال 1898 ، توسط "Marie Curie" و شوهرش Pierre ، کشف شد. آنها در طی مطالعاتشان بر روی اورانیت با حذف کردن اورانیوم به ماده ای برخوردند که هنوز خاصیت رادیو اکتیوی داشت. آنها با این عمل یک مخلوط رادیو اکتیو جدا کردند که بیشتر آن را باریم که شعله ای قرمز رنگ و درخشان داشت و هرگز قبلا ثبت نشده بود، تشکیل میداد. رادیوم خالص در سال 1902 بوسیله عمل الکترولیز محلول کلرید رادیوم با الکترود جیوه و تقطیر گاز هیدروژن توسط "Curie" و "Andre Debierne" بدست آمد. رادیوم مقدمهای برای شناخت انرژی اتمی و کاربرد آن بود.

یکی از مهمترین دستاوردهای ماری کوری این بود که پرتوهای رادیوم میتوانند بافتهای زنده اندامهای مختلف بدن موجودات را از بین ببرند. این کشف بزرگ مورد توجه بسیاری از پزشکان و پژوهشگرانی که در زمینه علوم زیستی فعالیت میکردند قرار گرفت و بزودی پزشکان دریافتند که میتوانند به کمک امواج رادیوم بافتها و تومورهای بدخیم در بیماران سرطانی را از بین ببرند و همچنین بیماران مبتلا به بیماریهای پوستی را نیز تحت درمان قرار بدهند.به این ترتیب بسیاری از بیماران سرطانی در سطح دنیا با استفاده از روشهای درمانی مبتنی بر کاربرد پرتوهای رادیواکتیو عنصر رادیوم تحت درمان قرار گرفته و از مرگ نجات یافتهاند. بدین ترتیب می توان رادیوم را عنصری در خدمت بیماری ها دانست.
از آنجا که رادیوم یکی از محصولات تجزیهای اورانیوم میباشد، در معادن اورانیوم یافت میشود. محصولات تجزیهای رادیوم که بهصورت رادیوم A، B،C و .. شناخته شده میباشند، در واقع ایزوتوپ عناصر دیگر هستند:
Radium emanation - radon-222
Radium A - polonium-228
Radium B - lead-214
Radium C - bismuth-214
Radium C1 - polonium-214
Radium C2 - thallium-210
Radium D - lead-210
Radium E - bismuth-210
Radium F - polonium 210
ویژگی ها
رادیوم که سنگین ترین فلز از فلزات قلیایی خاکی است، بسیار رادیو اکتیو بوده و از نظر شیمیایی به فلز باریم شباهت دارد. این فلز به صورت ترکیبی و در مقادیر بسیار کم در معادن اورانیوم یافت می شود. آماده سازی رادیوم برای نگهداری آن در دماهای بالاتر از دمای محیط با توجه به تشعشعات آلفا، بتا و گامای رادیوم بسیار قابل توجه است. مواد رادیو اکتیو میتوانند 3 اشعه مختلف تابش کنند که رادرفورد انها را اشعه الفا)، بتا) و گاما) نامید.
تفاوت هر کدام از اینها با دیگری در عملکرد ان در میدان مغناطیسی و میدان الکتریکی است که در تغییر مسیر اشعه های الفا) و بتا) است. همچنین رادیوم اگر در مجاورت برلیوم قرار بگیرد، نوترون تولید می کند.
بسیاری از بیماران سرطانی در سطح دنیا با استفاده از روشهای درمانی مبتنی بر کاربرد پرتوهای رادیواکتیو عنصر رادیوم تحت درمان قرار گرفته و از مرگ نجات یافتهاند. بدین ترتیب می توان رادیوم را عنصری در خدمت بیماری ها دانست
فلز رادیوم به صورت خالص به رنگ سفید براق می باشد که در مجاورت هوا به رنگ سیاه تغییر می یابد. (احتمالا این عمل به دلیل وجود ساختارهای نیتریدی آن رخ می دهد) رادیوم فلزی درخشان بوده و رنگ آبی کمرنگ از خود باز می تاباند. همچنین در آب تجزیه شده و هیدروکسید رادیوم می سازد که مقداری از باریم فرارتر است.
موارد استفاده عملی از رادیوم به خواص رادیواکتیوی آن برمیگردد:
* یک گرم رادیوم ، روزانه به مقدار 0.0001 میلیگرم گاز رادون از خود ساطع میکند که در درمان سرطانها موثر است.
* رادیوم قبلا بهصورت شبنما در ساعتها و ابزارهای شماره گیر استفاده میشد. البته امروزه این کاربرد بهدلیل زیاد شدن تاثیرات منفی که به خاصیت رادیواکتیوی آنها برمیگردد، منسوخ شده است.

* رادیوم بهعنوان یک منبع نوترونی با انرژی زیاد در مطالعات فیزیکی کاربرد دارد.
* رادیوم ( معمولا بهصورت کلرید رادیوم) برای تولید گاز رادون که در درمان سرطانها موثر است، در پزشکی هسته ای کاربرد دارد.
* کوری که واحد SI برای اندازه گیری خاصیت رادیو اکتیوی میباشد، بر اساس رادیوم 226 قرار داده شده است.
* رادیوم که از بزرگترین عناصر میباشد، همچنین در منابع نوترونی بهصورت ترکیبی با Francium بکار برده میشود.
رادیوم ، 25 ایزوتوپ گوناگون دارد که چهار تا از آنها در طبیعت یافت میشوند که رادیوم 226 بیشترین و پایدارترین آنهاست. Ra223 ، Ra224 ، Ra226 و Ra228 همه از تجزیه عنصر U یا Th بوجود میآیند. Ra226 محصول تجزیه عنصر U238 بوده که طولانیترین عمر ایزوتوپی رادیوم با نیم عمر 1602 سال را داراست. بعد از آن طولانیترین عمر ایزوتوپی متعلق به Ra228 است که با نیمه عمر 6.7 سال میباشد که حاصل تجزیه عنصر Th232 است.

رادیوم حدودا 1 میلیون برابر اورانیوم خاصیت رادیو اکتیوی دارد. تجزیه رادیوم در شش مرحله انجام میگیرد. محصولات اصلی و متوالی رادیوم که مورد مطالعه و بررسی قرار گرفتهاند، Emanation یا Exradio نام دارند: Radium A ، B ، C و … . (emanation یک گاز سنگین است و محصولات دیگر آن جامد میباشند.)
این عناصر که وزن اتمی آنها مقداری کمتر از وزن عناصر دیگر میباشد، عناصری ناپایدار هستند.
رادیوم در هر 25 سال 1% از فعالیت خود را از دست میدهد، چراکه به عناصری با وزن اتمی کمتر تبدیل میشود. سرب ، آخرین محصول تجزیه رادیوم میباشد. کوری واحد اندازگیری خاصیت رادیو اکتیوی میباشد که میزان تجزیه آن برابر با تجزیه یک گرم رادیوم 226 است.
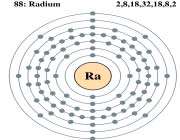
رادیوم سمی می باشد. رادیوم به شدت رادیواکتیو بوده و محصول تجزیه آن رادون برای ریه و شش بسیار کشنده است از آنجا که رادیوم با کلسیم در ارتباط است می تواند صدمات جدی را به دلیل جایگزینی در استخوان به وجود آورد استنشاق_ تزریق و یا تماس بدنی با رادیوم می تواند موجب سرطان شده و مشکلات جسمی دیگری را به وجود آورد. رادیوم ذخیره شده باید به هوا داده شود تا از جمع شدن و انباشتگی رادون جلوگیری به عمل آید.
انرژی ساتع شده از رادیوم گازها را به یون تبدیل می کند بر روی صفحات عکاسی تاثیر می گذارد باعث بوجود آمدن زخم بر روی پوست می شود و تاثیرات مهیج دیگری را نیز بر جای می گذارد. میزان این تاثیرات به مقدار رادیوم موجود بستگی دارد نه نحوه ترکیب شیمیایی آن.
فراوری مریم نایب زاده
بخش دانش وزندگی تبیان
منابع: daneshnameh.roshd-wiktipedia-jamejamonline -chemicalelement

